Description du haut-fourneau
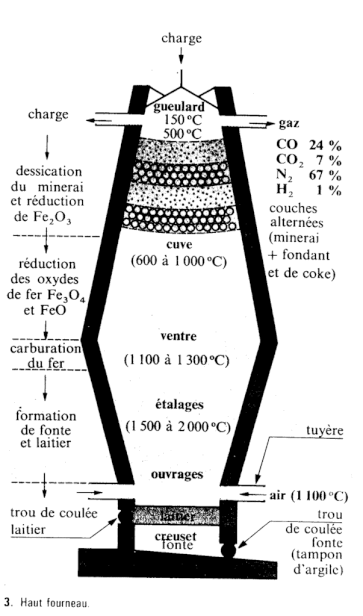
- Description du haut-fourneau
Voir figure.
2 . Réactions qui se produisent
Le mélange coke + minerai de fer (sous forme essentiellement d’oxyde de fer(III) Fe2O3) est enfourné par le gueulard, en haut. Au cours de la descente, les températures rencontrées sont de plus en plus élevées, ce qui favorise certaines réactions chimiques. La plupart d’entre elles libèrent de la chaleur, à commencer par la combustion du coke avec le dioxygène de l’air à la base du haut fourneau.
C + O2 ------> CO2
CO2 + C <====> 2 CO
C’est le monoxyde de carbone CO qui va, en montant dans le haut fourneau, réduire les oxydes de fer qu’il rencontre.
Près du gueulard, vers 500 °C :
3 Fe2O3 + CO ------> CO2 + 2 Fe3O4
(le rapport O/Fe passe de 3/2 à 4/3 :
L'acier au sens strict est une solution solide de carbone ( moins de 2%) dans le fer susceptible de durcir par trempe.
Le terme « fer » que l'on emploie de nos jours signifie « acier », il ne s'agit pratiquement jamais de « fer pur » ! Il faut admettre que l'usage en a fait des synonymes alors que ce n'est pas le même produit, mais, même les chimistes et les métallurgistes parlent souvent de fer quand il s'agit, en réalité, d'acier.
Diagramme binaire fer-carbone simplifié
Le diagramme binaire très simplifié montre que si la concentration de carbone dépasse 2 % il y a formation de l'eutectique qui contient 4,3 % de carbone, ce constituant étant caractéristique des fontes (parfois nommé ledéburite). Le domaine des aciers est limité à moins de 2 %, moins encore si l'on considère un possible refroidissement rapide qui ramènerait le point E sur la gauche à 1,75 %. Il a aussi moins de 0,05 % de soufre et phosphore qui sont des impuretés indésirables.
A - Quelques explications succintes sur ce diagramme :
- A ( 0 ;1534 ) : PF fer 100 %
- B ( 0,51 ; 1493 ou 1495 ) : palier péritectique fer + liquide <-> fer
γ
- C ( 4,3 ; 1147 ou 48 ) : C'est le point de la fonte blanche eutectique.
La ligne ABC représente le liquidus, ceci signifie que dans toute la partie inférieure du diagramme on est en solution
solide.
- E ( 2,06 ; 1147 ou 48 ) point du palier eutectique à 1147 ou 48 degrés. Si le refroidissement est très rapide ce point peut se déplacer vers
la gauche jusqu'à 1,75% de carbone, ceci limite la zone acier.
- G ( 0 ; 910 ) P ( 0,02 ; 723 ou 727 )
et Q ( 0 ; 500 ) limitent le triangle GPQdu fer α ou ferrite α.
- H ( 0,1 ; 1493 ou 95 ) point de solubilité maximum de C dans le fer δ entre 0,07 et 0,1 %.
- N ( 0 ; 1390 )
Le triangle AHN délimite l'existence du fer δ ou ferrite δ.
- S ( 0,77 ; 723 ou 727 ) la ligne 723 ou 727 est l'eutectoïde, fer γ <--> fer α
+ cémentite.
Les températures diffèrent un peu selon qu'on a de la cémentite ou dugraphite.
Il y a plusieurs solutions solides par insertion de carbone dans le fer- par opposition à solution par substitution - à savoir :
- L'austénite : solution de carbone dans le fer γ - gamma. Cristallise dans lesystème cubique faces centrées CFC. La présence de Nickel dans l'acier stabilise cette phase - donc augmente sa surface sur le diagramme - à tel point que si la teneur en nickel dépasse 18% on a de l'austénite jusqu'à température ambiante ! Si on refroidit de l'austénite à vitesse moyenne on obtient de la troosite très dure avec des lamelles de ferrite et de la cémentite. Si on la refroidit plus vite on a de la bainite en aiguilles et si on la refroidit très vite on obtient de la martensite.
- La perlite : eutectoïde formé par le fer et le carbone à 723 degrés
- La ferrite α et δ : solution de carbone dans le fer qui cristallise dans le système cubique centré. Ces deux ferrites cristallisent dans le système cubique centré CC. Le chrome dans l'acier stabilise la phase alpha.
- La cémentite de formule Fe3C formée de 12 atomes de fer pour 4 de carbone, de structure orthorhombique et qui a la propriété de se décomposer avant de fondre ce qui empêche de connaître toute la partie à droite du point C dans le diagramme binaire.
- La martensite : constituant dur des aciers qui cristallise en plaquettes ou en aiguilles et qui prend naissance par refroidissement brutal de l'austénite qui empêche une diffusion du carbone dans le fer, la martensite est très dure mais très fragile.
B - Les paliers isothermes du diagramme binaire :
Chaque palier correspond à la coexistence de 3 phases en équilibrethermodynamique à température constante : règle des phases de Gibbs.
Le péritectique à 1495 °C : on est en présence d'une solution de fer liquide à 0.53 % de carbone en poids de C, et de 2 solutions solides de la ferrite delta à 0,09 % de C et de l'austénite à 0,017 % de C.
L'eutectique à 1148 °C : les 3 phases sont les suivantes : une solution de fer liquide à 4,26 % de C et deux phases solides, de l'austénite à 2,11 % de C et du graphite ou de la cémentite.
L'eutectoïde à 727 °C : c'est l'équilibre entre 3 phases solides : la ferrite alpha à 0,021 % de C, l'austénite à 0,77 % de C (composition de
l'eutectoïde) et la cémentite ou le graphite. A l'état solide c'est la réaction isotherme de l'eutectoïde qui régit les transformations de l'austénite. La transformation de l'austénite commence
par la ferrite si le % de C < 0,77 % et par la cémentite ou le graphite si % de C est compris entre 0,77 et 2,11 %.
A 727 °C ces réactions sont interrompues par la transformation de l'austénite à 0,77% en ferrite à 0,021 % et la cémentite ou le graphite.
En dessous de 727 °C on trouve un domaine biphasé de ferrite et de cémentite mais la solubilité du C dans la ferrite diminue quand la
température descend et on observe une décomposition de la ferrite, sursaturée en C, par précipitation de cémentite selon la réaction :
Ferrite alpha sursaturée -> cémentite + ferrite alpha résiduelle.
C - Quelques détails autour de 1495 degrés.
Le point péritectique détermine la transformation des phases lors de la solidification des aciers dont les pourcentages en poids de carbone sont compris entre 0,09 et 0,53 %.
En abaissant la température depuis le point de solidification on a d'abord :
Liquide -> fer delta + liquide.
Lorsque le pourcentage de carbone du fer liquide atteint 0,53 à 1495 degrés on a 3 phases : la solution de fer-carbone à 0,53 %, la ferrite delta solide et l'austénite solide. A ce moment il n'y a plus de degré de liberté (3 phases à P fixée -> T fixée aussi !).
A la fin de la réaction péritectique les alliages à teneur en C comprise entre 0,09 et 0,17 % sont composés d'un mélange de ferrite delta et d'austénite alors que ceux dont la teneur en C
est comprise entre 0,17 % et 0,53 % de C sont composés d'austénite et de fer liquide.
L'alliage à 0,17 % de C est entièrement austénitique.
D - Comment le carbone se place dans le réseau cristallin CFC et CC.
Fer CC et carbone
Le carbone se place sur les arêtes des cubes des mailles élémentaires des structures de l'acier que ce soit cubique centré ou cubique faces centrées. Voir les 2 schémas ci-dessus et ci-dessous.
Fer CFC et carbone
On peut calculer la compacité d'une maille, le déplacement contraint que doivent effectuer les atomes de fer pour laisser la place et donc encore le remplissage de carbone dans la maille d'acier.
La compacité d'une maille de fer Cubique Centrée sera d'environ 68 %. La compacité d'une maille de fer Cubique Faces Centrées sera d'environ 74%.La maille CFC est plus compacte que la maille CC. La diffusion du carbone dans le fer se fera au niveau de l'arête d'une maille. Un atome de carbone a un diamètre = 154 pm. Pour une maille CC, chaque atome de fer du côté de la maille devra se déplacer de δ = 39% environ. Pour une maille CFC on aura un déplacement de l'atome de fer de δ = 15% environ.Le fer α a un coefficient de remplissage inférieur (0.68) - il y a donc plus de « vide » - à celui du fer γ (0.74) mais l'insertion du carbone y est plus difficile - les atomes doivent s'y « déplacer » davantage.
E - Considérons encore quelques points particuliers de l'acier :
1. Le point de Curie à 769 °C : magnétisme et température.
Entre 0 et 769 on a du fer alpha, ferromagnétique, cubique centré. Entre 769 et 910 on a du fer que l'on appelait jadis beta (dénomination qui n'existe plus) mais entre ces 2 températures s'il n'y a pas de changement structurel, il est toujours cubique centré, il devient en revanche paramagnétique.Entre 910 et 1390 on a du fer gamma, cubique faces centrées et paramagnétique.
Et entre 1390 et 1536 on a du fer delta, de nouveau cubique centré mais toujours paramagnétique. En dessus de 1536 le fer est liquide.
2. Evolution du volume spécifique en fonction de la température à P atm.
Entre 0 et 910 °C le volume spécifique passe de 0,1270 cm3.g-1 à 0,1321 de façon continue et rectiligne puis une brusque contraction apparaît au changement de structure à 910 °C avec un volume spécifique qui diminue fortement et brutalement à cette température (CC -> CFC) passant à 0,1307 soit une diminution de 1,03 %. Puis il remonte à 0,1351 jusqu'à 1390 )C où il y a le deuxième changement de structure (CFC -> CC) avecune augmentation de volume brusque à 1390 °C, mais pas aussi importante que la première variation, et le volume spécifique passe à 0,1358 soit une augmentation de 0,54 % ; puis augmente jusqu'à 0,1372 à 1536 °C, ce qui est normal.
Mais au moment du passage à l'état liquide une brusque dilatationapparaît avec un volume spécifique qui passe brusquement à 0,1421 cm3g-1 soit une dilatation de 3,58 % à la fusion.
3. Taille des grains d'austénite.
La taille des grains d'austénite varie avec plusieurs facteurs dont la température : une température de chauffage plus importante donnera des grains plus gros de manière générale, mais ce n'est pas toujours le cas suivant la composition de l'acier et si l'évolution du diamètre des grains n'est pas linéaire avec la température à Patm, ceci peut avoir une grande importance pour le laminage à chaud de l'acier, par exemple.
4. Vitesse de refroidissement de l'austénite.
Lorsque la vitesse de refroidissement de l'austénite est plus grande qu'une certaine valeur critique (entre 100 et 1000 °C / sec selon la teneur en carbone de l'acier), la ferrite, la perlite et la bainite obtenues lors du refroidissement lent sont alors remplacées par de la martensite en lattes ou en aiguilles selon la teneur en carbone.
F - La fabrication de l'acier
Pour effectuer une décarburation de la fonte on doit oxyder le carbone contenu dans cette dernière. Bessemer créa le convertisseur qui porte son nom en 1855. Bessemer mis son procédé en application dans ses usines de Sheffield. Ce procédé utilisait un four cornu qui pouvait être incliné pour le déchargement. De grandes quantités d'air étaient insufflées dans la masse de fonte fondue. Pour cela une puissante soufflerie était nécessaire. L'oxygène se combinait alors chimiquement avec le carbone.
Four Bessemer
Bessemer est le premier à faire monter la température assez haut pour convertir la fonte en acier, il faut en effet atteindre 1600 degrés. Son four est construit en réfractaire de silice, acide, et la combustion carbone et silice entraîne une augmentation suffisante de température pour la transformation recherchée. En France le premier convertisseur a été construit en Gironde à Saint Saurin sur l'Isle. Mais. Il y a toujours un mais, l'acidité de la silice nécessitait l'utilisation d'une fonte sans phosphore c'est à dire très pure et ceci empêchait toute utilisation du minerai lorrain !
Il fallu attendre 1877, et Thomas découvrit la possibilité d'éliminer le phosphore en créant un four dont le revêtement est basique et non plus siliceux. En utilisant de la chaux il obtient un acier doux qui suscitait la méfiance…, au point qu'Eiffel construira sa tour en fer puddlé et non en acier!
1900, enfin, est la première année où l'utilisation de l'acier dépasse celle du fer puddlé…
1930 voit l'avènement de l'aciérie électrique, utilisée pour la récupération des ferrailles. Elles sont introduites dans le four et les électrodes forment des arcs puissants pour fondre les ferrailles. Ce procédé est très consommateur d'énergie et pose certains problèmes, à la Chine, actuellement qui n'a pas encore de distribution suffisante d'électricité pour sa très forte demande en acier. En revanche il permet un recyclage très important des fers et aciers à tous les niveaux, ce qui présente globalement un bilan écologique très favorable.
En 1950 fut inventé le convertisseur à l'oxygène pur.
L'oxydation est très rapide par rencontre de l'oxygène pur avec
le métal en fusion. Les déchets sont le
laitier de silice, l'oxyde de manganèse et un peu d'oxydes ferreux et ferrique qui surnagent. Les gaz sont éliminés à
mesure
Basic oxysteelmaking principe de fonctionnement
Le tableau ci-dessous indique les pourcentages d'impuretés que l'on cherche à éliminer de la fonte pour obtenir un bon acier et le résultat obtenu (indicatif).
|
--- |
% C |
% Mn |
% Si |
% P |
% S |
PF en °C |
|
Fonte liquide |
4,7 |
0,23 |
0,26 |
0,08 |
0,02 |
1370 |
|
Acier liquide |
0,05 |
0,1 |
0 |
0,015 |
0,015 |
1670 |
Les procédés de réduction directe sont utilisés fréquemment
 Expertise Supervise Contrôle Conseil - ESCCAL
Expertise Supervise Contrôle Conseil - ESCCAL